La actual tabla periódica está ordenada según la configuración electrónica, pero, ¿qué es la configuración electrónica? La configuración electrónica (o C.E) indica la posición de cada electrón dentro de la envoltura nuclear, indicando en el nivel energético en el que éste se encuentra y en que orbital. Cada electrón puede ser identificado específicamente gracias a sus cuatro números cuánticos, los cuales son:
Ahora para poder seguir avanzando en la configuración electrónica debemos conocer primero unos ciertos principios que nos ayudarán a comprender mejor como se desarrolla este tema. Dichos principios son:
Si se fijan arriba hablé de los orbitales degenerados o con energías iguales, pero, ¿de dónde salen?, ¿cómo se sabe cuántos orbitales degenerados existen y quién los determina? Bueno la respuesta a estas preguntas las da el número cuántico magnético, ya que él es el encargado de indicarnos la orientación espacial de los orbitales. Ahora les colocaré un ejemplo para que quede mucho más claro todo esto que hasta aquí suena algo enredado.
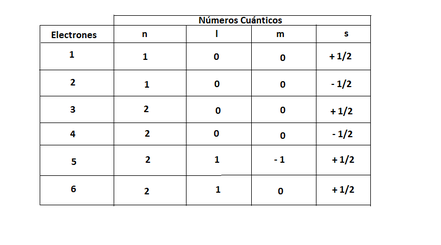
Por ejemplo, vamos a analizar los 6 electrones del átomo de carbono (C)
Imagen 9: Análisis de los 6 electrones del carbono en relación a sus números cuánticos.
Ahora para poder seguir avanzando en la configuración electrónica debemos conocer primero unos ciertos principios que nos ayudarán a comprender mejor como se desarrolla este tema. Dichos principios son:
Si se fijan arriba hablé de los orbitales degenerados o con energías iguales, pero, ¿de dónde salen?, ¿cómo se sabe cuántos orbitales degenerados existen y quién los determina? Bueno la respuesta a estas preguntas las da el número cuántico magnético, ya que él es el encargado de indicarnos la orientación espacial de los orbitales. Ahora les colocaré un ejemplo para que quede mucho más claro todo esto que hasta aquí suena algo enredado.
Por ejemplo, vamos a analizar los 6 electrones del átomo de carbono (C)
Imagen 9: Análisis de los 6 electrones del carbono en relación a sus números cuánticos.
Como se puede ver en la imagen de arriba, cada electrón esta individualmente identificado por ciertos números cuánticos, y no existen dos electrones que se repitan los mismos cuatros números (principio de exclusión), también se puede ver que los electrones 5 y 6 se encuentran en orbitales degenerados, debido a que la orientación de los orbitales es distinta (máxima multiplicidad). Según la tabla el primer electrón entró en el de menor energía, el segundo, lo llenó (Principio de Pauling) y el tercero se situó en el que le seguí en energía (Principio de Aufbau). Los niveles de energía de los orbitales, y los orbitales existentes en cada nivel energético.
Si uno se da cuenta, la tabla de arriba es algo engorrosa cuando un átomo tenga más electrones, por lo que se necesita un método más simplificado para escribir exactamente lo mismo, es ahí donde se crea la configuración electrónica, la que para el ejemplo que hemos puesto, sería como sigue:
1s2 2s2 2px1 py1 pz0
Nótese que, a pesar de que en el último orbital degenerado no existen electrones, de igual manera se anota. Es importante recalcar que tanto las letras x, y, z (estas letras indican la orientación espacial de los orbitales) que figuran abajo de los orbitales p, como así también el orden de llenado (primero x, luego y, para finalizar en z) es por convención, debido a que, como los tres orbitales poseen la misma energía da lo mismo si un electrón entra en x, y o z.
Imagen 10: Tabla periódica actual
Imagen 11: Niveles energéticos de los orbitales atómicos según un diagrama de Moeller. La cola de la flecha indica cual se llena primero, mientras que la punta indica cual se llena al último. Se empieza desde abajo hacia arriba (obtenida desde http://www.xtec.es).

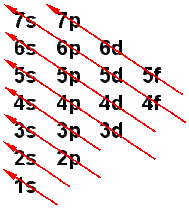
Esto me va a funcionar mucho, gracías por tu información.
ResponderEliminarExcelente información
ResponderEliminar